Alkének

Az alkének azok a telítetlen nyílt láncú szénhidrogének, amelyek molekulájában egy kettős kötés található. Régies olefin nevük onnan származik, hogy a kisebb rendszámú alkének halogének addíciójával olajszerű termékké alakultak. A legegyszerűbb alkén az etilén. A molekulában lévő szénatomok közti kettős kötések száma szerint léteznek mono-, di-, triolefinek. Az egy kettős kötést tartalmazó alkének homológ sort alkotnak. Általános képletük: CnH2n. Léteznek gyűrűs olefinek is, ezek neve cikloalkén vagy cikloolefin.
Csoportosításuk
Az alapján, hogy az alkének hány kettős kötést tartalmaznak, a monoolefin, diolefin, triolefin, poliolefin stb. csoportokra oszthatók. A kettő vagy több kettős kötést tartalmazó alkének neve: polién vagy poliolefin. A diolefinek avagy diének, a két kettős kötést tartalmazó alkének, melyek az alapján csoportosíthatók, hogy a kettős kötések egymáshoz képest hogyan helyezkednek el. A kumulált diénekben a két kettős kötés közvetlenül egymás mellett található. A konjugált diénekben a kettős kötések között egy, az izolált diénekben kettő vagy kettőnél több egyszeres kötés található.
Izoméria
Az alkánokhoz hasonlóan az alkéneknél is fellép a szerkezeti (konstitúciós) izoméria. Több szerkezeti izomerjük lehetséges, mint az alkánoknak, mert olyan izomerek is léteznek, amelyekben a kettős kötés helyében van különbség. Például háromféle négy szénatomos monoolefin létezik, a 2-metilpropén, a but-1-én és a but-2-én.
Cisz-transz izoméria
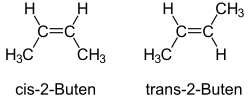
Az alkénekben nem lehetséges rotáció (elfordulás) a kettős kötés körül. Ezért az etilén 1,2-diszubsztituált származékainak (olyan származékainak, amelyben a mindkét szénatomon helyettesítve van 1-1 hidrogén valamilyen csoporttal) tekinthető alkéneknél fellép a cisz-transz izoméria (régebbi nevén geometriai izoméria). A cisz-transz izoméria a sztereoizoméria egyik fajtája, azaz az izomerek között csak az atomok térbeli elhelyezkedésében van különbség. A but-2-énnek például két sztereoizomerje létezik, ezek neve cisz-but-2-én és transz-but-2-én. Az előbbiben a két metilcsoport a kettős kötés azonos, az utóbbiban az ellentétes oldalán található. A kétféle izomert szokás Z, illetve E betűkkel is jelölni. A cisz-transz izomerek közül mindig a cisz-változatnak nagyobb az energiatartalma, a transz-izomer a stabilabb.
Fizikai tulajdonságaik
A monoolefinek homológ sorának első három tagja szobahőmérsékleten gáz-halmazállapotú, az 5 és a 15 közti szénatomszámúak folyadékok, az ennél több szénatomot tartalmazók szilárdak. A konjugált diének közül a butadién gáz (forráspontja -4,4 °C), az izoprén és a gyűrűs ciklopentadién cseppfolyós halmazállapotú. Apoláris vegyületek, ezért vízben alig, szerves oldószerekben jól oldódnak.
Kémiai tulajdonságaik
Az alkének nagyon reakcióképes vegyületek, szemben a kis reakciókészségű alkánokkal. Amíg általában a telített szénhidrogénekre a szubsztitúciós reakciók a jellemzők, addig az alkéneknél az addíciós reakciók a meghatározók.
Addíciós reakciók
A nyílt láncú alkének hidrogénnel alkánokká, a gyűrűs cikloolefinek cikloalkánokká telíthetők. A hidrogénaddíció nikkel vagy platinakatalizátor jelenlétben játszódik le. A nyílt láncú olefinek telítésének reakcióegyenlete:
Az alkének halogénekkel nagyon könnyen addíciós reakcióba lépnek. A reakciókészség Cl < Br < I irányban nő. Az addíciót indifferens, a reakció szempontjából közömbös oldószerben végzik. A brómaddíció egyrészt az alkének kétszeres kötésének kimutatására használható, az addíció során a bróm színe eltűnik. Másrészt átmenetileg megvédhető vele a kettős kötés, mert a két brómatom cink segítségével könnyen eltávolítható (elimináció). A brómaddíció egyenlete:
Az alkének könnyen addícionálnak hidrogén-halogenideket is. Az addíció során alkil-halogenidek keletkeznek. A hidrogén-halogenidek addíciójára általában érvényes a Markovnyikov-szabály: az alkén úgy addícionálja a hidrogén-halogenidet, hogy a hidrogénje a kettős kötésnek ahhoz a szénatomjához kötődik, amelyhez eleve is több hidrogén kapcsolódott, a halogénatom pedig a másik szénatomhoz kapcsolódik. Például a propilén hidrogén-jodid addíciója például 2-jód-propánhoz vezet.
A hidrogén-bromid addíciója oxidálószerek jelenlétében azonban nem a Markovnyikov-szabály szerint történik. (A hidrogén arra a szénatomra lép be, ahol eredetileg kevesebb hidrogén volt). A reakciókészség hidrogén-halogenidek esetén HCl < HBr < HI irányban nő.
Az alkének kénsavaddíciója is a hidrogén-halogenid addícióhoz hasonló módon játszódik le. A reakcióban alkilhidrogénszulfátok, savanyú kénsavészter jellegű vegyületek képződnek. A Markovnyikov-szabály itt is érvényes, például propilénből izoporpil-hidrogénszulfát keletkezik. A reakció gyakorlati jelentősége nagy, mert a keletkezett észterek alkoholokká hidrolizálhatók, és így alkénekből alkoholok állíthatók elő.
Az alkének hipoklórossav-addíciójánál a Markovnyikov-szabály úgy érvényesül, hogy a halogén kapcsolódik ahhoz a szénatomhoz, amelyen több hidrogén van. A keletkező klórhidrinek gyakorlati jelentősége nagy.
Polimerizáció
A polimerizáció vagy poliaddíció az alkének fontos és nagy gyakorlati jelentőségű reakciója. Polimerizáció során nagyon sok alkénmolekula kapcsolódik össze óriásmolekulává. A polimerizáció is addíciós folyamatnak tekinthető. A polimerizáció savakkal vagy peroxidokkal katalizálható, a katalizátor a reakció mechanizmusát is befolyásolja. Az alkének és az alkénszármazékok polimerizációs termékei fontos műanyagok, etilén polimerizációjakor polietilén, propilénből polipropilén, sztirolból polisztirol, vinil-kloridból PVC, izoprénből kaucsuk, kloroprénből klórkaucsuk keletkezik. A polimerizáció általános reakcióegyenlete:
Oxidációs reakciók
Az alkének telítetlen kötése érzékeny oxidációval szemben. Enyhébb oxidáció során (például hidrogén-peroxiddal oxidálva vagy kálium-permanganát hatására lúgos közegben) az alkének először epoxidokká oxidálódnak. Az epoxidok háromtagú gyűrűs heterociklusos vegyületek, a gyűrűjükben oxigénatom található. Gyűrűs étereknek tekinthetők, igen reakcióképes vegyületek. Az oxidációkor keletkező epoxidok víz hatására könnyen kétértékű alkoholokká hidrolizálnak. A legegyszerűbb alkén, az etilén oxidációjakor például először etilén-oxid keletkezik, majd ez hidrolizál etilénglikollá.

Az alkének kálium-permanganáttal lúgos közegben végzett oxidációja a telítetlen kötés kimutatására használható, mert a reakció a permanganát elszíntelenedésével jár (Baeyer-próba).
Az alkének erőtejes oxidációjakor kettős kötésük felhasad, az eredetileg a kétszeres kötést alkotó szénatomok karboxilcsoporttá oxidálódnak. A reakcióban karbonsavak keletkeznek, but-1-énből egy molekula hangyasav és egy molekula propionsav, but-2-énből két molekula ecetsav.
Oxidációs reakció az ozonidos lebontás is. Az alkének ózon hatására gyűrűs ozonidok keletkeznek, ez a reakció is a kétszeres kötés elszakadásával jár. A keletkező ozonidok instabilak, robbanékonyak, víz hatására oxovegyületekre (aldehidekre és/vagy ketonokra) és hidrogén-peroxidra hidrolizálnak. Az ozonidos lebontás a kettős kötés helyének meghatározására használható. Izobutilén (2-metilpropén) lebontásakor például aceton és formaldehid keletkezik.
Szubsztitúciós reakciók
Az alkének szubsztitúciós reakciói kevésbé jelentősek, mint az addíciós reakciók, egyedül a halogénezés jelentős. Az allilhelyzetű szénatomhoz (A kétszeres kötéshez közvetlenül kapcsolódó telített szénatomhoz) kapcsolódó hidrogénatomok bizonyos módszerekkel halogénre cserélhetők. Az allilhelyzetű brómozás N-bróm-szukcinimiddel végezhető el, az alkén kloroformos oldatának forralásával (Ziegler-féle brómozás). A propén 500 °C-on klórozható az allilhelyzetű szénatomján, allilklorid keletkezik. Ez egy gyökös mechanizmus szerint lejátszódó szubsztitúciós reakció.
Előállításuk
Az alkének telített vegyületekből eliminációval állíthatók elő. Az elimináció során a telített vegyület két szomszédos atomjáról egy-egy atom vagy atomcsoport távozik.
Alkének nyerhetők telített szénhidrogénekből dehidrogénezéssel. Iparilag a fontosabb szénhidrogéneket a kőolaj krakkoló lepárlásával gyártják. A krakkolást magas hőmérsékleten (800-900 °C) végzik, a krakkolás dehidrogéneződéssel jár. A keletkező gázelegy (krakkgázok) fontos alkéneket, etilént, propilént és butiléneket tartalmaz.
A vicinális dihalogénezett szénhidrogénekből (olyan szénhidrogénekből, amelynek két szomszédos szénatomjához is halogénatom kapcsolódik) fémek, például cink vagy réz segítségével a két halogénatom eltávolítható. A halogénatomok helyén kettős kötés jön létre. Az eliminációt nátrium-jodid katalizálja. (A nátrium-jodid hatására a vegyületből dijódszármazék keletkezik, majd ez lép reakcióba a fémmel.) A brómatomok eliminációja cinkkel a következő egyenlet szerint játszódik le:
Alkoholokból vízelvonással (például kénsav hatására) szintén alkének keletkeznek.
Halogénezett szénhidrogénekből tömény lúg hatására lejátszódó elimináció során szintén kétszeres kötést tartalmazó vegyületek képződnek.
Források
- Bot György: A szerves kémia alapjai
- Furka Árpád: Szerves kémia
- Kovács Kálmán, Halmos Miklós: A szerves kémia alapjai
- Bruckner Győző: Szerves kémia, I/1-es kötet.
 Kémiaportál • összefoglaló, színes tartalomajánló lap
Kémiaportál • összefoglaló, színes tartalomajánló lap





![{\displaystyle \mathrm {n\ CH_{2}{=}CH{-}R\rightarrow [-CH_{2}{-}CHR-]_{n}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/359fe9bb5f011d5fb128c192d43a3b671e6bd3e4)













