Selenium trioksida
| |||
| Penanda | |||
|---|---|---|---|
Nomor CAS |
| ||
Model 3D (JSmol) |
| ||
| 3DMet | {{{3DMet}}} | ||
| ChemSpider |
| ||
| Nomor EC | |||
PubChem CID |
| ||
| Nomor RTECS | {{{value}}} | ||
CompTox Dashboard (EPA) |
| ||
InChI
| |||
SMILES
| |||
| Sifat | |||
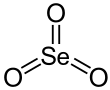
Rumus kimia | SeO3 | ||
| Massa molar | 126.96 g/mol | ||
| Penampilan | Kristal higroskopik putih | ||
| Densitas | 3.44 g/cm3 | ||
| Titik lebur | 11.835 °C (21.335 °F; 12.108 K) | ||
| Titik didih | menyublim | ||
Kelarutan dalam air | sangat mudah larut | ||
| Struktur | |||
Struktur kristal | tetragonal | ||
| Bahaya | |||
Klasifikasi UE (DSD) (usang) | tidak terdaftar | ||
| Dosis atau konsentrasi letal (LD, LC): | |||
LD50 (dosis median) | 7 mg/kg (tikus, lewat mulut) 7.08 mg/kg (tikus, lewat mulut) 5.06 mg/kg (marmut, lewat mulut) 2.25 mg/kg (kelinci, lewat mulut) 13 mg/kg (kuda, lewat mulut)[2] | ||
LC50 (konsentrasi median) | 13 mg/kg (babi, lewat mulut) 9.9 mg/kg (sapi, lewat mulut) 3.3 mg/kg (kambing, lewat mulut) 3.3 mg/kg (domba, lewat mulut)[2] | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
 N verifikasi (apa ini N verifikasi (apa ini  Y Y N ?) N ?) | |||
| Referensi | |||
Selenium trioksida adalah senyawa anorganik dengan rumus SeO3. Senyawa ini merupakan senyawa higroskopik yang padat dan berwarna putih. Senyawa ini juga tergolong sebagai oksidator dan asam Lewis. Bahan ini adalah mendahulu senyawa Se(VI).[3]
Preparasi
Selenium trioksida sulit disiapkan karena dioksidanya sangat tidak stabil:
- 2 SeO3 → 2 SeO2 + O2
Senyawa ini telah dibuat dengan sejumlah cara walaupun dioksidanya tidak terbakar dalam keadaan normal.[3] Salah satu metodenya memerlukan proses dehidrasi asam selenat anhidrat dengan fosfor pentoksida pada suhu 150–160 °C. Cara lain adalah dari reaksi sulfur trioksida cair dengan kalium selenat
- SO3 + K2SeO4 → K2SO4 + SeO3
Reaksi
SeO3 memiliki karakteristik yang lebih menyerupai sulfur trioksida SO3 daripada telurium trioksida, TeO3.[3]
Pada suhu 120 °C SeO3, bereaksi dengan selenium dioksida dan membentuk senyawa Se(VI)-Se(IV):[4]
- SeO3 + SeO2 → Se2O5
Selenium trioksida juga dapat bereaksi dengan selenium tetrafluorida dan membentuk selenoil fluorida (analog sulfuril fluorida):
- SeO3 + SeF4 → SeO2F2
Jika direaksikan dengan litium oksida dan natrium oksida, unsur ini dapat membentuk garam SeVIO54− dan SeVIO66−:[5]
Referensi
- ^ Lide, David R. (1998). Handbook of Chemistry and Physics (edisi ke-87). Boca Raton, FL: CRC Press. hlm. 4–81. ISBN 0-8493-0594-2.
- ^ a b "Selenium compounds (as Se)". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ^ a b c Egon Wiberg, Arnold Frederick Holleman (2001) Inorganic Chemistry, Elsevier ISBN 0123526515
- ^ Z. Žák "Crystal structure of diselenium pentoxide Se2O5" Zeitschrift für anorganische und allgemeine Chemie 1980, volume 460, pp. 81–85. doi:10.1002/zaac.19804600108
- ^ Handbook of Chalcogen Chemistry: New Perspectives in Sulfur, Selenium and Tellurium, Franceso A. Devillanova, Royal Society of Chemistry, 2007, ISBN 9780854043668
 | Artikel bertopik kimia ini adalah sebuah rintisan. Anda dapat membantu Wikipedia dengan mengembangkannya. |
- l
- b
- s