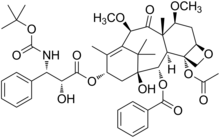
カバジタキセル
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| ライセンス | US FDA:リンク |
| 胎児危険度分類 |
|
| 法的規制 |
|
| 投与経路 | 点滴静注 |
| 識別 | |
| CAS番号 | 183133-96-2 |
| ATCコード | None |
| PubChem | CID: 9854073 |
| DrugBank | DB06772 |
| KEGG | D09755 |
| 化学的データ | |
| 化学式 | C45H57NO14 |
| 分子量 | 835.93 g/mol |
| |
| |
| テンプレートを表示 | |
カバジタキセル (Cabazitaxel) は、サノフィが開発したタキサン骨格を持つ抗がん剤であり[1]、微小管の脱重合を阻害することにより腫瘍縮小効果を発揮する。商品名ジェブタナ。開発コードXRP-6258。
米国、欧州でホルモン治療抵抗性前立腺癌への適応が認められている[2][3]。
2014年7月4日、日本においても「前立腺癌」を対象効能・効果として承認された[4]。
他のタキサンよりもP糖タンパク質への親和性が低いので、他のタキサンに耐性の腫瘍に対して奏効する可能性がある他、血液脳関門を通過する[5]。
臨床試験
第III相臨床試験には755人の去勢抵抗性前立腺癌患者が登録された。中央生存期間はカバジタキセル群が15.1ヶ月、対照群(ミトキサントロン)が 12.7ヶ月であった。
カバジタキセル群ではグレード3および4の好中球減少症が81.7%の患者に発現した[6]。一方のミトキサントロン群では58%であった。
副作用
本剤の過敏反応を軽減させるために、本剤投与に先立って、抗ヒスタミン薬、副腎皮質ホルモン、ヒスタミンH2受容体拮抗薬などの前投与が必要である。
また、重大な副作用として、下記の副作用が挙げられている[7]。(頻度未記載は頻度不明)
- 骨髄抑制(好中球減少症(30.1%)、発熱性好中球減少症(12.5%)、貧血(10.6%)、白血球減少症(7.0%)、リンパ球減少症(0.2%)、血小板減少症(5.5%)、好中球減少性敗血症(0.7%)、敗血症性ショック(0.7%)など)、
- 感染症(16.1%)、播種性血管内凝固症候群(DIC)、静脈血栓塞栓症(1.2%)、
- 腎不全(1.0%)、肝不全、肝機能障害、急性膵炎、不整脈(1.0%)、心不全、心筋梗塞、
- 消化管出血(1.0%)、消化管穿孔、イレウス(0.2%)、重篤な腸炎(0.5%)、重篤な下痢(5.1%)、
- 心タンポナーデ、浮腫(3.9%)、体液貯留、アナフィラキシーショック、
- 末梢神経障害、皮膚粘膜眼症候群(Stevens-Johnson症候群)、間質性肺疾患(肺臓炎、急性呼吸窮迫症候群など)
日本国内で実施された第I相臨床試験では、好中球減少、貧血、白血球減少の発現率はいずれも100%、リンパ球減少 88.6%、血小板減少 72.7%であり、中でも好中球減少は全例がグレード3以上であった。
他のタキサンに比べて神経毒性が弱いとされる[5]。
2014年12月、発熱性好中球減少症による死亡例が5例報告された事を受け、厚生労働省はサノフィに対して添付文書を改定し医療機関への情報提供(リスク因子の理解と予防措置、ならびに早期の適切な処置)を実施するよう命じた[8]。上記の重大な副作用欄にはその旨が反映されている。
関連項目
出典
- ^ “cabazitaxel”. 2014年9月4日閲覧。
- ^ 『Jevtana(cabazitaxel)注、優先審査を経て米国FDAより承認を取得』(PDF)(プレスリリース)。http://www.sanofi.co.jp/l/jp/ja/download.jsp?file=950A172A-EB92-4D3A-96F4-7D0ABFB5D0F1.pdf。2014年9月3日閲覧。
- ^ 『JEVTANA(一般名:cabazitaxel)進行性前立腺がんの二次療法に関し、欧州委員会の承認を取得』(PDF)(プレスリリース)。http://www.sanofi.co.jp/l/jp/ja/download.jsp?file=48D4ECDF-FD2D-4E3E-9BB0-DC8F310BAA46.pdf。2014年9月3日閲覧。
- ^ 『前立腺がん治療薬「ジェブタナ点滴静注60mg」の製造販売承認取得について』(PDF)(プレスリリース)。http://www.sanofi.co.jp/l/jp/ja/download.jsp?file=BDD3A41D-54B8-45EB-97A0-FA42B0954FA0.pdf。2014年9月3日閲覧。
- ^ a b “Cabazitaxel: Just another taxane for prostate cancer?” (2011年1月25日). 2014年9月16日閲覧。
- ^ “Cabazitaxel Effective for Hormone Refractory Prostate Cancer After Failure of Taxotere”. 2010年6月10日閲覧。[リンク切れ]
- ^ “ジェブタナ点滴静注60mg 添付文書” (2016年10月). 2016年11月4日閲覧。
- ^ “厚労省 死亡例発生でジェブタナの添付文書改訂を指示 G-CSFの予防投与も考慮” (2014年12月24日). 2014年12月24日閲覧。
外部リンク
- Cabazitaxel - Official web site of manufacturer.
- Cabazitaxel Prescribing Information - Official prescribing information.
- U.S. National Library of Medicine: Drug Information Portal - Cabazitaxel
細胞内作用化学療法剤/抗悪性腫瘍剤(L01) | |||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 紡錘体毒/ 分裂抑制剤(M期) |
| ||||||||||||||||||||||||||||
| DNA複製阻害剤 |
| ||||||||||||||||||||||||||||
| 光増感剤/PDT | |||||||||||||||||||||||||||||
| その他 |
| ||||||||||||||||||||||||||||
| #WHO必須医薬品モデル・リスト ‡市場から撤退した医薬品一覧(英語版) 治験: †第III相 §第II相以下 | |||||||||||||||||||||||||||||
- 表示
- 編集





