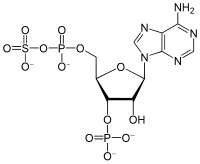
3'-Fosfoadenozin-5'-fosfosulfat
 | |
| Nazivi | |
|---|---|
| IUPAC naziv 6-Amino-9-[(2R,3R,4S,5R)-3-hidroksi-5- [(hidroksi-sulfooksi-fosforil)oksimetil] -4-fosfonooksi-tetrahidrofuran-2-il]purin | |
| Drugi nazivi Fosfoadenozin fosfosulfat 3'-Fosfo-5'-adenilil sulfat | |
| Identifikacija | |
3D model (Jmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.222.927 |
IUPHAR/BPS |
|
| |
SMILES
| |
| Svojstva | |
| C10H15N5O13P2S | |
| Molarna masa | 507,266 |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |
 Y verifikuj (šta je Y verifikuj (šta je  Y Y Н ?) Н ?) | |
| Reference infokutije | |
3'-Fosfoadenozin-5'-fosfosulfat (PAPS) je derivat adenozin monofosfata koji je fosforilisan u 3' poziciji i ima sulfatnu grupu vezanu za 5' fosfat. Ovaj anjon je najčešći koenzim u sulfotransferaznim reakcijama. Srodni anjon je adenozin 5'-fosfosulfat (APS), koji nije fosforilisan u 3' poziciji.[3]
Formiranje i redukcija
APS i PAPS su intermedijeri u redukciji sulfatata do sulfita, egzotermnoj konverziji koju izvode sulfat redukujuće bakterije. U tim organizmima, sulfat služi kao akceptor elektrona, poput upotrebe O2 kao elektron akceptora kod aerobnih organizama. Sulfat se ne redukuje direktno, nego se mora aktivirati putem formiranja APS ili PAPS. Ovi nosači aktiviranog sulfata se formiraju reakcijom sa ATP-om. Prvu reakciju katalizuje ATP sulfaraza:
- SO42- + ATP → APS + PPi
Konverziju APS u PAPS katalizuje APS kinaza:
- APS + ATP → PAPS + ADP
Redukcijom APS-a se proizvodi sulfit, koji se dalje redukuje do vodonik sulfida, i zatim izlučuje. Taj proces se naziva disimilatorna sulfatna redukcija. Redukcijom PAPS-a nastaje sulfatni estar, i zatim vodonik sulfid. Međutim u ovom slučaju, proizvod se koristi u biosintezi, e.g. produkciji cisteina.[4]
Reference
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003. уреди
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Negishi, M.; Pedersen, L. G.; Petrotchenko, E.; et al. (2001). „Structure and function of sulfotransferases”. Arch. Biochem. Biophys. 390 (2): 149—57. PMID 11396917. doi:10.1006/abbi.2001.2368.
- ^ M. T. Madigan, J. M. Martinko, J. Parker “Brock Biology of Microorganisms”. . Prentice Hall. 1997. ISBN 978-0-13-520875-5. Недостаје или је празан параметар
|title=(помоћ)
- п
- р
- у
| vitamini | |
|---|---|
| ne-vitaminski | ATP · CTP · SAMe · PAPS · GSH · Koenzim B · Kofaktor F430 · Koenzim M · Koenzim Q · Hem (A, B, C, O) · Lipoinska kiselina · Metanofuran · Molibdopterin/Molibdenski kofaktor · PQQ · THB / BH4 · THMPT / H4MPT |
| minerali |
| |||||








