Fumarase
| FH | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Pengecam | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Alias | FH, fumarate hydratase, HLRCC, LRCC, MCL, MCUL1, FMRD, Fumarate hydratase, HsFH | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Pengecam-pengecam luaran | OMIM: 136850 MGI: 95530 HomoloGene: 115 GeneCards: FH | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Fumarase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Pengenal pasti | |||||||||
| Nombor EC | 4.2.1.2 | ||||||||
| Nombor CAS | 9032-88-6 | ||||||||
| Pangkalan data | |||||||||
| IntEnz | Lihat IntEnz | ||||||||
| BRENDA | Entri BRENDA | ||||||||
| ExPASy | Lihat NiceZyme | ||||||||
| KEGG | Entri KEGG | ||||||||
| MetaCyc | Laluan metabolik | ||||||||
| PRIAM | Profil | ||||||||
| Struktur PDB | RCSB PDB PDBj PDBe PDBsum | ||||||||
| Ontologi gen | AmiGO / EGO | ||||||||
| |||||||||
Fumarase (atau fumarate hydratase) ialah enzim (EC 4.2.1.2) yang memangkinkan penghidratan/dehidrasi berbalik fumarat kepada malat. Fumarase datang dalam dua bentuk: mitokondrion dan sitosol. Isoenzim mitokondria terlibat dalam kitaran Krebs, manakala isoenzim sitosol terlibat dalam metabolisme asid amino dan fumarat. Penyetempatan subsel ditubuhkan dengan kehadiran jujukan isyarat di terminal amino dalam bentuk mitokondrion, manakala penyetempatan subsel bentuk sitosol ditubuhkan dengan ketiadaan jujukan isyarat yang terdapat dalam varian mitokondrion.[4]
Enzim ini mengambil bahagian dalam 2 laluan metabolik: kitaran asid sitrik dan kitaran asid sitrik reduktif (penetapan CO2), dan juga penting dalam karsinoma sel renal. Mutasi dalam gen ini telah dikaitkan dengan perkembangan leiomioma pada kulit dan rahim dalam kombinasi dengan karsinoma sel renal (sindrom HLRCC ).
Nomenklatur
Enzim ini tergolong dalam keluarga liase, khususnya hidroliase yang membelah ikatan karbon-oksigen. Nama sistematik kelas enzim ini ialah (S)-malate hidroliase (pembentuk fumarat). Nama lain yang biasa digunakan termasuk:
- fumarase
- L-malat hidroliase
- (S)-malat hidroliase
Struktur
Gen
Pada manusia, gen FH disetempatkan pada kedudukan kromosom 1q42.3-q43. Gen FH mengandungi 10 ekson.
Protein
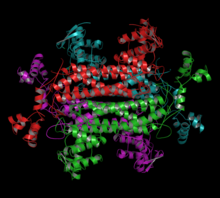
Struktur kristal fumarase C daripada Escherichia coli telah diperhatikan mempunyai dua tapak pengikat dikarboksilat yang berdekatan antara satu sama lain. Ini dikenali sebagai tapak aktif dan tapak B. Tapak-tapak ini disambungkan oleh satu siri ikatan hidrogen, dan akses kepada mana-mana tapak hanya melalui bukaan berhampiran permukaan enzim berhampiran tapak B.[5] Tapak aktif terdiri daripada tiga domain. Walaupun tiada ligan yang terikat pada tapak aktif, poket pengikat yang dicipta oleh sisa-sisa sekeliling cukup untuk mengikat air di tempatnya.[5] Penyelidikan kristalografi di tapak B enzim telah memerhatikan bahawa terdapat pergeseran di His129 antara keadaan bebas dan diduduki. Ia juga mencadangkan bahawa penggunaan pertukaran imidazola-imidazolium mengawal akses ke tapak alosterik B.[5]
Subjenis
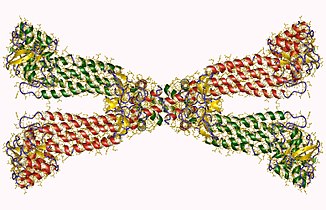
Terdapat dua kelas fumarase, kelas I dan kelas II.[6] Pengelasan bergantung pada susunan subunit relatifnya, keperluan ion logamnya, dan kestabilan habanya. Fumarase Kelas I ialah keadaan berubah atau tidak aktif apabila tertakluk kepada haba atau sinaran, sensitif kepada anion superoksida, bergantungan besi (Fe2+), dan merupakan protein dimer dengan setiap subunit terdiri daripada sekitar 120 kD. Fumarase kelas II yang terdapat dalam prokariot dan juga dalam eukariot ialah enzim tetramer dengan subunit 200 kD yang mengandungi tiga segmen berbeza bagi asid amino homolog yang ketara. Ia juga bebas besi dan stabil dari segi haba. Prokariot diketahui mempunyai tiga bentuk fumarase yang berbeza: Fumarase A, Fumarase B dan Fumarase C. Fumarase A dan Fumarase B daripada Escherichia coli dikelaskan sebagai kelas I, manakala Fumarase C adalah sebahagian daripada fumarase kelas II.[7]
Fungsi
Mekanisme

Rajah 1 menggambarkan mekanisme tindak balas fumarase. Dua sisa memangkinkan pemindahan proton, dan keadaan pengionan sisa ini sebahagiannya ditentukan oleh dua bentuk enzim, E1 dan E2. Dalam E1, kumpulan-kumpulan itu wujud dalam keadaan AH/B yang dineutralkan secara dalaman, manakala dalam E2, ia hadir sebagai zwiterion A-/BH+. E1 mengikat fumarat dan memudahkan transformasinya menjadi malat, dan E2 mengikat malat dan memudahkan transformasinya menjadi fumarat. Kedua-dua bentuk mesti menjalani pengisomeran dengan setiap pusing ganti pemangkin.[8]

Walaupun dengan kepentingan biologinya, mekanisme tindak balas fumarase belum difahami sepenuhnya. Tindak balas itu sendiri boleh dipantau dalam mana-mana arah; bagaimanapun, pembentukan fumarat daripada S-malat khususnya yang kurang difahami disebabkan oleh nilai pKa tinggi atom HR (Rajah 2) yang dikeluarkan tanpa bantuan mana-mana kofaktor atau koenzim. Tindak balas fumarat kepada S-malat lebih difahami, dan melibatkan penghidratan stereospesifik fumarat untuk menghasilkan S-malat melalui penambahan trans kumpulan hidroksil dan atom hidrogen. Penyelidikan awal terhadap tindak balas ini mencadangkan bahawa pembentukan fumarat daripada S-malat melibatkan penyahhidratan malat kepada perantaraan karbokation yang kemudiannya kehilangan proton alfa untuk membentuk fumarat. Ini membawa kepada kesimpulan bahawa pembentukan S-malat berlangsung sebagai tindak balas penyingkiran E1 - pemprotonan fumarat untuk menghasilkan karbokation diikuti dengan penambahan kumpulan hidroksil daripada H2O. Walau bagaimanapun, ujian lebih terbaharu telah memberikan bukti bahawa mekanisme itu sebenarnya berlaku melalui penghapusan bermangkin asid-bes melalui perantaraan karbanionik, bermakna ia diteruskan sebagai penghapusan E1cB (Rajah 1).[8][9][10]
Laluan biokimia
Fungsi fumarase dalam kitaran asid sitrik adalah untuk memudahkan langkah peralihan dalam penghasilan tenaga dalam bentuk NADH.[11] Dalam sitosol, enzim berfungsi untuk memetabolismekan fumarat, yang merupakan hasil sampingan kitaran urea serta katabolisme asid amino. Kajian telah mendedahkan bahawa tapak aktif terdiri daripada sisa asid amino daripada tiga daripada empat subunit dalam enzim tetramerik.[7][8][9][10]
Substrat lain
Substrat utama fumarase ialah malat dan fumarat. Walau bagaimanapun, enzim juga boleh memangkinkan penyahhidratan D-tartrat yang menghasilkan enol-oksaloasetat. Enol-oksaloasetat kemudiannya boleh mengisomer menjadi keto-oksaloasetat. Kedua-dua Fumarase A dan Fumarase B pada asasnya mempunyai gaya kinetik yang sama bagi penukaran berbalik malat kepada fumarase, tetapi Fumarase B mempunyai kecekapan pemangkin yang lebih tinggi bagi penukaranD-tartrat kepada oksaloasetat berbanding Fumarase A.[12] Ini membolehkan bakteria seperti E. coli menggunakanD-tartrat dalam pertumbuhannya; pertumbuhan mutan dalamD-tartrat dengan gen yang mengganggu pengekodan fumB Fumarase B dikenal pasti terjejas teruk.[12]
Kepentingan klinikal
Kekurangan fumarase dicirikan oleh polihidramnios dan keabnormalan otak janin. Dalam tempoh baru lahir, penemuan termasuk keabnormalan neurologi yang teruk, pemakanan tidak baik, kegagalan berkembang maju dan hipotonia. Kekurangan fumarase disyaki pada bayi dengan pelbagai keabnormalan neurologi yang teruk tanpa ketiadaan krisis metabolik akut. Ketidakaktifan kedua-dua bentuk fumarase sitosol dan mitokondrion ialah punca berpotensi. Peningkatan kepekatan asid fumarik secara terpencil dalam analisis asid organik air kencing sangat menunjukkan kekurangan fumarase. Ujian genetik molekul untuk kekurangan fumarase kini tersedia.[6]
Fumarase banyak wujud dalam kedua-dua tisu janin dan dewasa. Peratusan besar enzim dinyatakan dalam kulit, paratiroid, limfa dan kolon. Mutasi dalam pengeluaran dan perkembangan fumarase telah membawa kepada penemuan beberapa penyakit berkaitan fumarase pada manusia. Ini termasuk tumor mesenkima benigna pada rahim, leiomiomatosis dan karsinoma sel renal, dan kekurangan fumarase. Mutasi germa dalam fumarase dikaitkan dengan dua keadaan yang berbeza. Jika enzim mempunyai mutasi salah erti dan pemadaman dalam bingkai dari hujung 3', kekurangan fumarase akan terhasil. Jika ia mengandungi mutasi dan pemadaman salah erti heterozigot 5' (mulai daripada satu pasangan bes hingga keseluruhan gen), maka leiomiomatosis dan karsinoma sel renal/sindrom Reed (leiomiomatosis berbilang kulit dan rahim) boleh berlaku.[7][6]
Rujukan
- ^ a b c GRCh38: Ensembl release 89: ENSG00000091483 - Ensembl, May 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ FH (fumarate hydratase)
- ^ a b c Weaver T (October 2005). "Structure of free fumarase C from Escherichia coli". Acta Crystallogr. D. 61 (Pt 10): 1395–401. doi:10.1107/S0907444905024194. PMID 16204892.
- ^ a b c "FH (fumarate hydratase)". Atlas of Genetics and Cytogenetics in Oncology and Haematology. 2006-07-01.
- ^ a b c "X-ray crystallographic and kinetic correlation of a clinically observed human fumarase mutation". Protein Sci. 11 (6): 1552–7. June 2002. doi:10.1110/ps.0201502. PMC 2373640. PMID 12021453.
- ^ a b c Hegemony AD, Frey PA (2007). Enzymatic reaction mechanisms. Oxford [Oxfordshire]: Oxford University Press. ISBN 978-0-19-512258-9.
- ^ a b Begley TP, McMurry J (2005). The organic chemistry of biological pathways. Roberts and Co. Publishers. ISBN 978-0-9747077-1-6.
- ^ a b Walsh C (1979). Enzymatic reaction mechanisms. San Francisco: W. H. Freeman. ISBN 978-0-7167-0070-8.
- ^ "Fumarase: a paradigm of dual targeting and dual localized functions". The FEBS Journal. 278 (22): 4230–42. 2011. doi:10.1111/j.1742-4658.2011.08359.x. PMID 21929734.
- ^ a b "Biochemical similarities and differences between the catalytic [4Fe-4S] cluster containing fumarases FumA and FumB from Escherichia coli". PLOS ONE. 8 (2): e55549. February 26, 2021. doi:10.1371/journal.pone.0055549. PMC 3565967. PMID 23405168.









